نظرية التصادم وسرعة التفاعل الكيميائي
نظرية التصادم وسرعة التفاعل الكيميائي تعتبر من النظريات المهمة، ولقد تم اكتشاف هذه النظرية في الفترة من عام 1916 لعام 1918، وكانت هذه النظرية قامت على دراسة التفاعلات الكيميائية المختلفة بشكل عام، كما أنها أكدت على اختلاف سرعة التفاعل بسبب اختلاف المواد المتفاعلة، بالإضافة إلى أنها تعطي شرح مفصل عن تصادم المواد المتفاعلة بعضها ببعض، ويطلق على التصادمات التي تحدث في التفاعل الكيميائي وتسبب النواتج بالتصادمات المثمرة، ولأهمية هذه النظرية سوف نقدم لكم من خلال موقع البلد شرح مفصل لنظرية التصادم وما يتعلق بها، فتابعونا.
نظرية التصادم وسرعة التفاعل الكيميائي
تتضمن هذه النظرية العديد من الافتراضات فمن هذه الفروض على سبيل المثال ما يلي:
الافتراض الأول
- يعتبر هذا الافتراض من الافتراضات المهمة في هذه النظرية وينص على أنه يجب أن يحدث هناك تصادم بين جميع المواد الداخلة في التفاعل الكيميائي.
- ومن هنا نستنتج أنه يجب حدوث تصادم بين المواد المتفاعلة قبل البدء في عملية التفاعل.
- إذن عملية التصادم تكون في البداية بعدها تأتي عملية التفاعل بين المواد.
الافتراض الثاني
- ينص على أن هناك تناسب بين كلاً من سرعة التفاعل الكيميائي وبين عدد التصادمات وهذا التناسب طردي.
- أي أنه كلما زاد التصادم بين المواد كلما زادت عملية التفاعل الكيميائي.
- وذلك كله يكون يتوقف على الزمن.
الافتراض الثالث
ينص على أن يكون التصادم فعالاً بين جميع المواد الداخل في عملية التفاعل الكيميائي.
شروط حدوث التصادم
هناك بعض الشروط اللازمة من أجل حدوث هذا التصادم في التفاعل الكيميائي وهذه الشروط كالتالي:
الشرط الأول
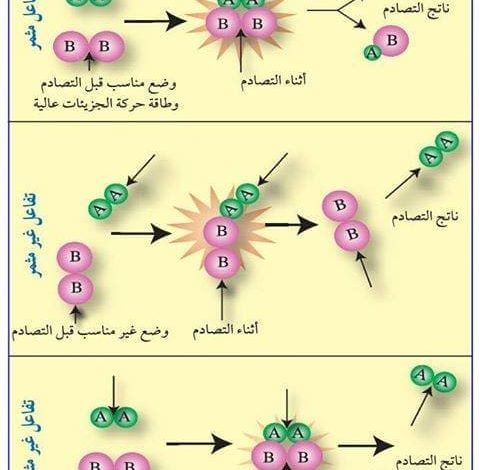
- لابد أن يكون اتجاه التصادم بين الجزيئات في اتجاه واحد.
- حيث أنه يحدث هناك نوع من أنواع التصادم من أجل تكوين مجموعة من النواتج.
- وهناك وضعين يتمان في هذه العملية أي في عملية التصادم أحدهما يعتبر وضع فعال والآخر يكون عبارة عن وضع غير فعال
الشرط الثاني
- يجب أن تكون المواد المتفاعلة تمتلك حد معين من الطاقة اللازمة يتم من خلاله كسر الروابط الموجودة في التفاعل الكيميائي.
- وعند تكوين مجموعة من الروابط الجديدة يتم تكوين العديد من النواتج ويجب أن نعلم أن هناك حد أدنى من البطاقة ويعرف بطاقة التنشيط.
- ويرمز لهذه الطاقة بالرمز Aa وذلك بمجرد حدوث التصادم وهناك يحدث نوع من أنواع التضاعف بين مجموعة المواد الداخلة في التفاعل.
- وبعدها يتم تكوين مجموعة من الروابط الجديدة بالنسبة للذرات.
- ومن هنا يتم تكوين وضع بناء ولكنه غير مستقر تماماً وهذا الأمر قد ينتج عنه طاقة وضع عالية.
- ويسمى هذا باسم المعقد المنشط ومن خلاله يتم عملية تكوين النواتج المختلفة.
- وبناءً على هذا الأساس فإن عملية التصادم التي تتم بين مجموعة من الدقائق التي تعتبر هي المالكة لكمية من طاقة التنشيط الفعالة.
- يحدث فيها التصادم في اتجاه مناسب وهذا ما قد تعرفنا عليه من خلال هذه النظرية الكيميائية المعروفة باسم نظرية التصادم الكيميائي.
نص نظرية التصادم
تعتبر هذه النظرية من النظريات القوية في التفاعل الكيميائي وتنص على ما يلي:
- أنه من أجل حدوث عملية التفاعل الكيميائي لابد من حدوث نوع من أنواع التصادم بين الجزيئات الداخلة في التفاعل.
- ولابد أن تكون الجزيئات المتفاعلة هي التي تمتلك حد كبير من الطاقة اللازمة.
- وذلك كله ينتج من أجل حدوث نوع من أنواع التصادم الفعالة.
العوامل المؤثرة في سرعة التفاعل الكيميائي
لابد أن نعلم أن هناك مجموعة من العوامل المختلفة التي يكون لها تأثير قوي في عملية التفاعل الكيميائي، فمن هذه العوامل التي يكون لها تأثير كبير في سرعة التفاعل الكيميائي على سبيل المثال ما يلي:
- تركيز المواد المتفاعلة حيث أنه هناك تناسب طردياً بين كلاً من عدد التصادمات وتركيز المواد.
- وهذا ينتج عنه أنه كلما زاد تركيز المواد الداخلة في التفاعل الكيميائي كلما زادت عملية التصادم بين الجزيئات.
- طبيعة المادة: كذلك تعتبر طبيعة المادة من العوامل المؤثرة في سرعة التفاعل الكيميائي.
- وذلك لأن المواد المتفاعلة تختلف في سرعتها وذلك تبعاً لاختلاف تركيبها الكيميائي بالإضافة إلى خصائصها.
- مساحة سطح المواد المتفاعلة وذلك يتم في حالتها الصلبة حيث أنه كلما كانت مساحة السطح كبيرة كلما زادت التصادمات.
الخاتمة
نظرية التصادم وسرعة التفاعل الكيميائي تعتبر من النظريات التي يجب تمعن النظر فيها ونتمنى من الله عز وجل أن نكون قد قدمناها بطريقة سهلة ميسرة على القارئ.